多肽和聚氨基酸都是氨基酸单体由酰胺键连 接的化合物,其化学结构具有较高的相似性,被 广泛应用于生物材料领域[ 1] . 鉴于氨基酸的多样 性和数以万计的排列顺序,人们可以构建大量具 有特定氨基酸序列和相应生物活性的多肽分 子[2,3] . 同时,聚氨基酸往往被认为是一类天然多 肽或蛋白质模拟物,可以通过氨基酸-N-羧基环 内酸酐开环聚合法合成[4,5] . 相较于聚氨基酸,多 肽由于具有更加复杂和精确的氨基酸序列,能够 实现更丰富的生物活性[6]; 而相较于多肽分子相 对单一的自组装行为,聚氨基酸在合成方法、 自 组装结构及构象转变等方面更具有多样性[7] .
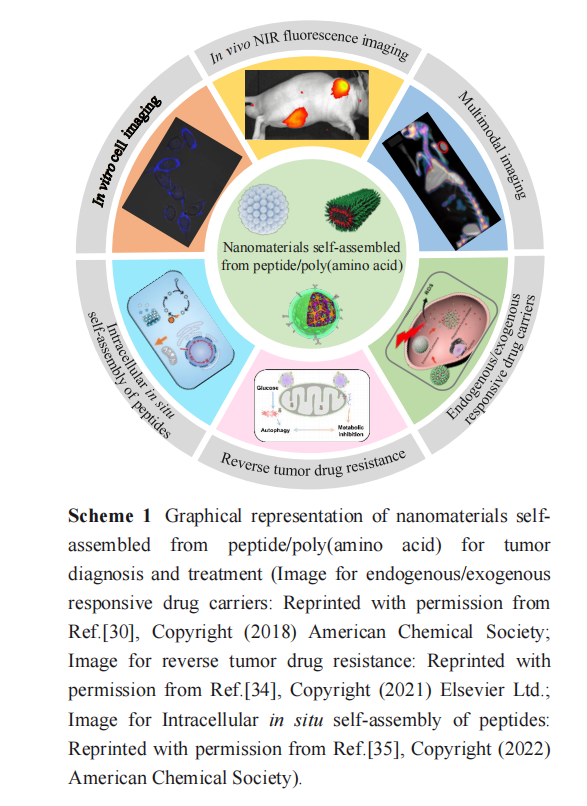
在过去几十年中,多肽/聚氨基酸分子由于 其相对简单的合成方法、独特的结构特征以及 内在的生物活性,逐渐成为生物材料的较为完 美构建模块,并广泛应用于肿瘤治疗领域(示意 图 1)[8~ 10] . 目前全球市场已有几十种多肽药物在 临床上显示了优异的治疗效果和广泛的应用前 景,其中约有 1/5 的多肽药物(如 Dolastatin 10、 Degarelix 、ATAP-M8 和IMM- 101 等)被应用于肿 瘤治疗[ 11] . 例如:Dolastatin 10 是一种海兔中分离 出来的抗有丝分裂肽,能够与β 微管蛋白的氨基酸残基结合,抑制微管的形成,阻滞细胞的有丝 分裂,使细胞停滞于细胞间期,对小细胞肺癌、 卵巢癌、黑色素癌和前列腺癌等具有较高的抑制 活性[ 12, 13] . 然而,多肽/聚氨基酸分子仍然存在一 定的缺陷,如光学性质不佳,半衰期短,清除速 率快等不足 , 限制了其更为广泛的生物医学 应用.
自然界中普遍存在生物分子的自组装现象 . 例如,肌动蛋白自组装为纤维状结构,微管蛋白 自组装形成细胞骨架微管[ 14, 15] . 与蛋白质自组装 类似,生物体中也存在一系列天然多肽的自组装 现象,如β-淀粉样多肽是淀粉样前体蛋白的裂解 产物,能够自组装形成斑块和纤维状物质[ 16, 17] .
与天然多肽自组装类似,人工合成的多肽/ 聚氨基酸分子也可以依靠分子内/分子间的相互 作用, 自发或触发地聚集在一起形成微纳结构 (包括纳米管[ 18, 19] 、纳米纤维[20,21] 、纳米胶束[22]、 纳米带[23] 、纳米环[24]和水凝胶[25]等). 目前,人们 设计并合成了越来越多的能够自组装的多肽/聚 氨基酸分子 . 例如,Gazit 等[26]受淀粉样蛋白序列 启发设计的二苯丙氨酸(FF)通过溶剂交换法可以 自组装形成中空的纳米管 . 通过对其端基进行修饰,还可以进一步调控组装体形貌(包括纳米纤 维、纳米球、纳米带和纳米棒等)[27,28] . Xu 等[29] 以多肽自组装形成的超分子水凝胶作为基质,对 氯化血红素进行封存,制备了比蛋白质结构更简 单且具有更高氧化反应活性的人工酶.
多肽/聚氨基酸分子自组装是一个自发的热 力学和动力学驱动的过程,基于多种非共价相互 作用的协同效应,形成具有最低能量状态且热力 学稳定的结构 . 相较于多肽/聚氨基酸分子在生理 环境中容易被网状内皮系统清除和蛋白酶裂解, 其自组装材料具有更高的侧链密度和有序的微纳 结构,形成空间位阻以保护酶切位点,降低了蛋 白酶与酶切位点的接触和亲和力,进而限制了体 内蛋白酶对多肽/聚氨基酸的裂解能力,使其在 生物系统中显示出更高的稳定性、体内长循环性 以及更好的生物利用度[30,31] . 例如:Yan 等[32] 通 过模拟具有金属结合作用的血红蛋白,发展了基 于含组氨酸短肽、卟啉衍生物光敏剂和Zn2+离子 的配位自组装策略,有效延长了多肽自组装材料 在生物体内的血液循环,增加了其在肿瘤处的积聚并增强了光动力肿瘤治疗的效果 . Chen 等[33]开 发了一种含有细胞膜插入片段、肿瘤酸性微环境 响应片段和Ca2+离子螯合片段的聚氨基酸,通过 链段的亲疏水性差异自组装成纳米颗粒,随后在 肿瘤酸性微环境下发生膨胀并构建矿化屏障,从 而阻止肿瘤与周围正常组织之间产生物质交换, 有效抑制原发瘤和肿瘤转移的发生.
然而,多肽/聚氨基酸自组装材料领域仍然 面临着一系列挑战,例如:( 1)如何突破20 种天 然氨基酸的结构局限来构建性能更好的多肽/聚 氨基酸材料以满足不同的生物医用需求;(2)如 何基于肿瘤微环境特点设计多肽/聚氨基酸材料, 揭示其结构和生物活性的构效关系,实现肿瘤耐 药性的有效逆转.
本文将重点介绍多肽/聚氨基酸自组装纳米 材料的设计理念及其在肿瘤诊疗领域的应用研 究,并展望该领域的挑战和发展前景.
1 多肽/聚氨基酸自组装纳米材料的 结构调控和功能化
不同的氨基酸在电荷、疏水性和极性等方面 表现的特性使得多肽/聚氨基酸能够自组装形成 多种结构和功能的纳米材料[36~38] ,其自组装驱动 力主要包括分子内或分子间非共价键作用力, 如: 范德华力、亲疏水作用[39] 、氢键[40] 、静电 作用[41]和π-π 相互作用[42] ,以及金属配位等[43] .
作为最常见的多肽类型,线性多肽/聚氨基 酸的合成技术无论是液相法还是固相法都已成 熟,其自组装行为也被广泛而深入的研究(图 1). 最典型的两亲性多肽/聚氨基酸由疏水和亲水链 段两部分组成,其具有传统表面活性剂的结构特 征 . Zhang 等[44] 设计了一系列由 2 个亲水的天冬 氨酸(Asp)和4~ 10 个疏水的甘氨酸(Gly)组成两亲 性线性多肽,该多肽在水溶液中可以自组装形成 纳米管和纳米囊泡,其中甘氨酸数目的增加会使 其疏水性过强导致纳米结构的离散 . 此外,多肽 自组装基元并非全由氨基酸组成,与其他组分的 缀合也可构建组装基元 . 例如: Stupp 等[23] 在 四肽 Val-Glu-Val-Glu 的N 端修饰了疏水的烷基 (C16H31O ―) ,使得该多肽分子具有更明显的亲疏 水差异,可自组装成具有完全扁平结构的纳米 带; 同时,pH 值和多肽浓度的改变会影响静电 排斥和氢键相互作用的平衡,从而使纳米带转变为扭曲的丝带状结构.
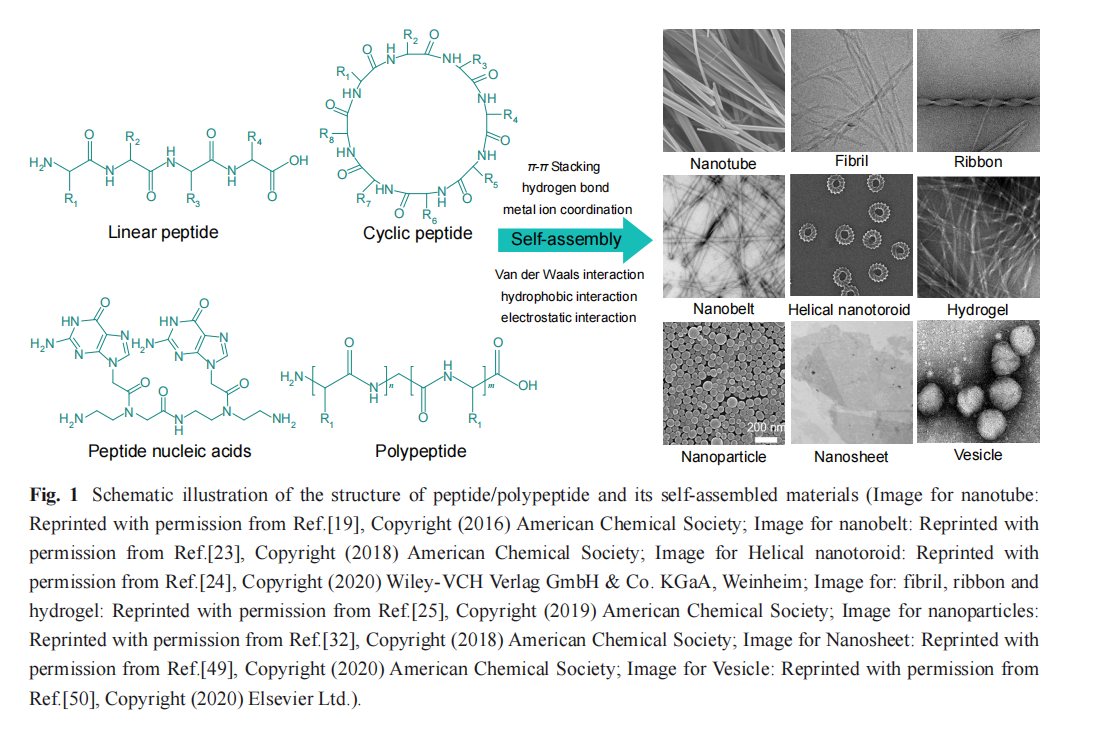
然而,线性多肽在液相中的柔性构象难以符 合一些受体的构象要求 . 为了获得生物性质稳 定、受体选择性高的多肽,将线性肽改造成环状 多肽是最为广泛使用和有效的方法之一[45] . 环肽 具有更明确的固定构象,能够与受体很好地契 合;与线性多肽不同,其不存在C 端和N 端游离 的羧基和氨基,使得对氨肽酶和羧肽酶的敏感性 大大降低[46,47] . 例如:Ghadiri 等[48]设计了一种D/L-氨基酸交替的环八肽(cyclo-((D-Ala-Glu-D-Ala- Glu)2-)) ,其具有偏二维的环状构象, 由骨架酰 胺基团之间垂直于环平面取向的氢键驱动其自组 装,堆叠形成中空的具有β 折叠纳米管状结构 . Montenegro 等[49] 在此基础上在进一步探索了环 肽中不同的氨基酸对于其自组装的影响,设计并 合成了非对称的环八肽(cyclo- (D-Leu-Trp-D-Leu- His-D-Glu-Gln-D-His-Glu- ))并通过多级自组装形 成了具有均一厚度的纳米片.
随着高分子化学的发展,可以高效合成多功 能嵌段聚氨基酸,其在选择性溶剂中可自组装形 成形貌丰富、结构多样的纳米材料,有望作为药 物、疫苗和核酸递送载体[51] . Lin 等[52] 制备了一 种基于聚谷氨酸苄酯(PBLG)和聚乙二醇(PEG)的 三嵌段聚氨基酸(PBLG-b-PEG-b-PBLG) ,研究 了PBLG 嵌段长度和反应条件对其自组装行为的 影响 . 当PBLG 较短时,该聚氨基酸可以自组装 成囊泡;而PBLG 长度的增加时,则诱导囊泡转 变成纳米球.
DNA 纳米技术的发展实现了脱氧核糖核酸 分子的可编程排列和组装. 将DNA 与多肽结合形 成肽核酸,不仅可以丰富20 种天然氨基酸固有的理化性能,还能利用Watson-Crick 碱基互补配 对能力实现自组装过程的分子级精确控制 . 肽核 酸是以多肽主链为骨架,取代DNA 的糖磷酸主 链 ,在侧链修饰嘧啶/嘌呤(A 、C 、G 、T)的类 DNA ,可以通过碱基配对识别并结合 DNA 序 列,从而形成稳定的双螺旋结构;也可以通过氢 键和 π-π 堆叠作用等进行自组装,获得丰富的纳 米结构. Ly 等[53]通过在γ 位碳上修饰丝氨酸侧链, 使肽核酸的无规则卷曲转化为右螺旋结构,并以 高亲和力和序列选择性与DNA 结合,通过碱基 互补配对进一步稳定自组装结构. Stephanopoulos 等[54]将互补的DNA 折纸结构修饰到具有自组装 性能的多肽主链上,实现了DNA 折纸技术与多肽自组装的结合.
外场/内源响应性可进一步提高多肽/聚氨基 酸载体材料的生物利用度 . Zhang 等[55]报道了一 种在超声作用下可动态重组的离子互补型多肽 Ac- (Arg-Ala-Asp-Ala)4-CONH2 , 能够自组装为 纳米纤维并最终形成宏观水凝胶支架 . 超声刺激 能够破坏纳米纤维支架的氢键、离子键以及疏水 相互作用,使其裂解为纤维片段;停止超声后, 纤维片段又通过可逆的非共价键重新自组装成具 有原始形貌的纳米纤维 . 因此,可利用该特点制 备用于组织工程的纤维类生物材料.
具有电荷翻转能力的多肽/聚氨基酸材料通 常等电点小于pH=7.4 ,在正常的生理环境下带 负电荷,而在特定条件下(如肿瘤微环境中) ,因多肽/聚氨基酸序列中氨基质子化程度的提高而 转变为带正电荷,进而提高生物利用度 . Wang 等[56]设计并合成了含有疏水性多肽序列Lys-Leu- Val-Phe-Phe 、pH 响应多肽序列(聚组氨酸)及亲水 链段(PEG)的聚氨基酸,其在中性条件下可自组 装形成纳米颗粒;在酸性肿瘤微环境下,该纳米颗粒发生电荷翻转,提高了进胞效率 . 此外,通 过去质子化、响应性化学键断裂等手段同样可以实现多肽/聚氨基酸自组装纳米材料的电荷翻转[57] .
2 多肽/聚氨基酸自组装纳米材料 在生物成像领域的应用
癌症因其发病机理的复杂性和多样性对人类 的生命健康构成了严重威胁[58] . 目前,生物成像 技术已为肿瘤的早期诊断和治疗提供了重要的病 理信息[59,60] . 临床常用的成像手段包括正电子发 射断层扫描(PET) 、 电子计算机断层扫描(CT)、 单光子发射计算机断层扫描(SPECT)与磁共振成 像(MRI)等 . 通过注射造影剂,能够获得生物体 的结构和解剖学信息,有望实现肿瘤的可视化监 测[61,62] . 同时,近年来通过赋予多肽/聚氨基酸自 组装纳米材料新的理化性质,使其能够作为新型 造影剂或造影剂靶向载体,进而获得高分辨率高 对比度的图像[63,64] . 与传统造影剂相比,多肽/聚 氨基酸自组装材料不仅可以通过自组装形成量子 限域结构或通过侧链修饰荧光分子,也可以高效 负载用于不同成像手段的造影剂,使其具有靶向 特定病变区域的能力,可以降低传统造影剂的毒性并实现多模态成像.
荧光成像(FLI)因其简便、灵活、无创和原 位可操作性等优点而在医学诊断和影像引导手术 等应用中展现出广阔的前景[62] . 目前用于荧光成 像的探针以有机荧光分子和无机量子点为主[65] . 然而,无机量子点固有的不可降解性以及可能存 在的长期毒性限制了其在生物医学方面的进一步 应用[66] . 尽管有机荧光分子在一定程度上克服了 细胞毒性问题,但其相对较弱的稳定性、光漂白性以及较窄的Stokes 位移仍限制了其获得高特异 性和高分辨率的生物影像[67] .
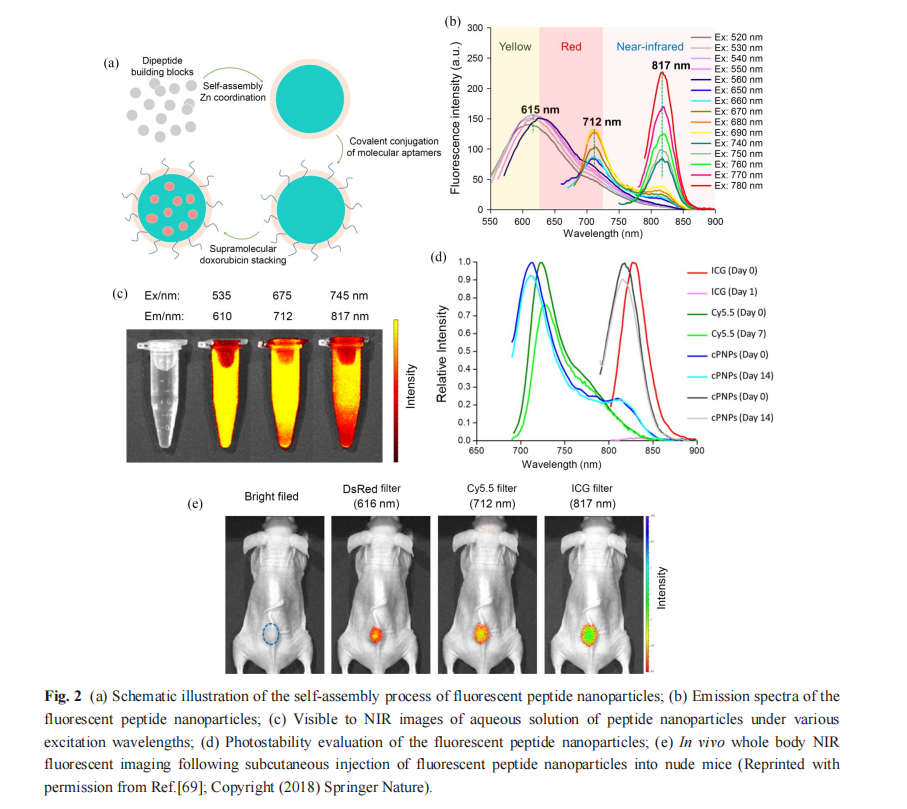
例如:受黄色荧光蛋白的荧光红移(J 型 π-π 堆积作用)和蓝色荧光蛋白的荧光增强现象(金属 配位)启发,Fan 等[68]设计并合成了具有良好的光 稳定性的自荧光多肽纳米颗粒, 以Trp-Phe 二肽 作为基元,通过Zn2+配位、苯环叠加和氢键相互 作用自组装成纳米粒(图2(a)) ,使其荧光波长从 天然氨基酸的不可见紫外区域红移到可见光区 域,实现了特异性细胞成像和药物释放的实时 监测.
在上述研究基础上,他们进一步设计了C 端 和N 端首尾相连的环状多肽组装单元,获得了具 有量子限域效应的纳米颗粒,其自荧光进一步红 移至红色和近红外区域(图2(b)和2(c)) [69] . 其中, 近红外光谱窗口内的光子提供了低吸收、低散射 和较低的组织生物自荧光,从而获得了优异的穿 透能力[70] . 与常用的近红外荧光分子吲哚菁绿 (ICG)和花菁 5.5 (Cy5.5)相比,该自荧光环肽纳 米颗粒具有更好的稳定性(图2(d)). 通过皮下注射 该纳米粒,能够观察到其在小鼠体内明显的荧光 信号,有望应用于活体近红外肿瘤成像(图2(e)). 此外,他们还利用原子力显微镜和基质辅助激光 解吸电离质谱分析,结合理论计算模型,揭示了 自荧光多肽纳米材料中的量子限域效应.
Wang 等[71]通过原位自组装制备了近红外荧 光多肽材料,其在肿瘤病变中具有肿瘤特异性排 泄 延 迟 (tumor-specific excretion-retarded , TER) 效应,可对肾肿瘤进行高性能成像,并实现肿瘤 完全切除,最终减少术后复发 . 该多肽由靶向性 序 列 Arg-Gly-Asp (RGD) 、 酶 响 应 性 序 列 Pro- Leu-Gly-Tyr-Leu 、 自组装序列 Gly-Phe-Phe-Cys 和花菁基团组成 . 首先通过RGD 靶向肿瘤病灶, 随后被肾癌细胞内过表达的基质金属蛋白酶-2/9(MMP-2/9)裂解,余下的多肽残基在肿瘤病灶处 进一步原位自组装形成纳米纤维(图3(a)). 相较于 对照组,注射该多肽组的小鼠肿瘤部位具有更 强的荧光信号,表现出了理想的排泄延迟效应 (图 3(b)和 3(c)). 此外,通过比较荧光强度发现,在注射纳米粒后,肿瘤部位成像的信噪比得到了显著提高(图3(d)). 在原位肾细胞癌模型中,整个肿瘤边界清晰可见,因此该材料有望应用于荧光成像引导的肿瘤手术(图3(e)).

计算机断层扫描(CT) 、磁共振成像(MRI)和 正电子发射断层成像(PET)也被广泛应用于肿瘤 诊断成像[72] . 但是 ,每种成像方式都有其优缺 点. 例如:CT 可以提供解剖信息,但灵敏度有待 提高;MRI 可以提供软组织和脑功能信息,但检查费用高、检查时间长;PET 具有较高的灵敏 度,但可检测的疾病有限 . 因此,如何实现这些 成像技术的优势互补是当前研究的重点.
多模态成像是一种更综合、更高效的策略, 它结合了多种成像方式,有望提供高空间分辨率 的解剖学信息和时间分辨率上高灵敏度的生物学 信息,并可以获得患病部位的新信息,以便进行 更早期、更精确的诊断和治疗[72] .
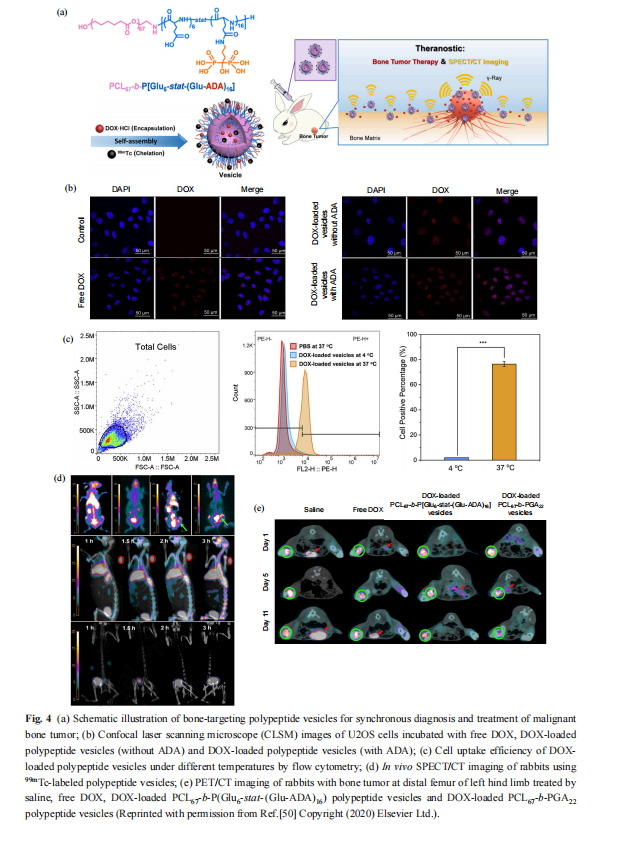
SPECT/CT 是一种较新的双模态成像技术, 它不仅能够提供分子生物学信息,还可提供解 剖学信息,从而提高诊断效果[73] . 然而,临床常 用的 SPECT/CT 造影剂 , 如99 mTc 、 123I 和 111In, 缺乏靶向能力,毒副作用大,而且诊断精确度不高[74] . 多肽/聚氨基酸自组装材料可以通过鳌合负载相关造影剂并利用特定多肽序列靶向病灶 处以提高成像诊断的精准性和造影剂的生物相 容性. Du 等[50]通过自组装制备了一种具有多模态 成像功能的骨靶向聚氨基酸囊泡,可同时用于成 像诊断和治疗恶性骨肿瘤 . 他们利用亲骨性多肽 作为骨靶向基团和自组装骨架,同时在聚氨基酸 链段上修饰阿仑磷酸(ADA) ,其既可与骨组织中 的羟基磷灰石结合靶向骨组织,又可与核素锝结 合并用于骨肿瘤的 SPECT/CT 成像(图 4(a)). 同 时,通过共聚焦荧光成像(图4(b))和流式细胞术 (图 4(c))验证了聚氨基酸囊泡较高的进胞效率 . 此外,在原位骨肿瘤兔模型中,通过 SPECT/CT 动态监测阿仑磷酸螯合的99 mTc 以观察体内的药 物分布(图4(d));体内 SPECT/CT 成像显示,给药后3h,骨组织处的影像信号逐渐增强;而注射 游离99 mTc 的兔子仅在肾脏和膀胱中观察到信号, 这证明了该聚氨基酸囊泡的骨靶向成像能力(图4 (e)) ,为实现针对骨肿瘤的实时成像诊断和有效 治疗提供了新策略.
除了 SPECT/CT 双模成像, 自组装多肽/聚 氨基酸纳米材料还能够有效负载多种类型的显像 剂以用于其他多模态成像,如荧光成像/计算机 断层扫描、荧光成像/磁共振成像、磁共振成像/ 计算机断层扫描等[75] .
3 多肽/聚氨基酸自组装材料在肿 瘤治疗领域的研究进展
目前,临床上已经应用多种方案来治疗恶性肿瘤,如手术治疗、化学药物治疗、放射治疗、 免疫治疗、激素疗法等[76] . 其中,利用具有广谱 抗肿瘤活性的小分子化疗药物治疗肿瘤是目前临 床上的主流手段,但常规的化学药物对肿瘤缺乏 选择性,会无差别杀伤正常细胞与组织,导致严 重的毒副作用 . 多肽/聚氨基酸分子由于具有丰富 的生物活性、优良的生物相容性和化学可修饰 性,因此可作为与药物、功能基团结合的理想分 子,在改善药代动力学、增强药物靶向性和控制 药物释放方面表现出了显著优势[77,78] .
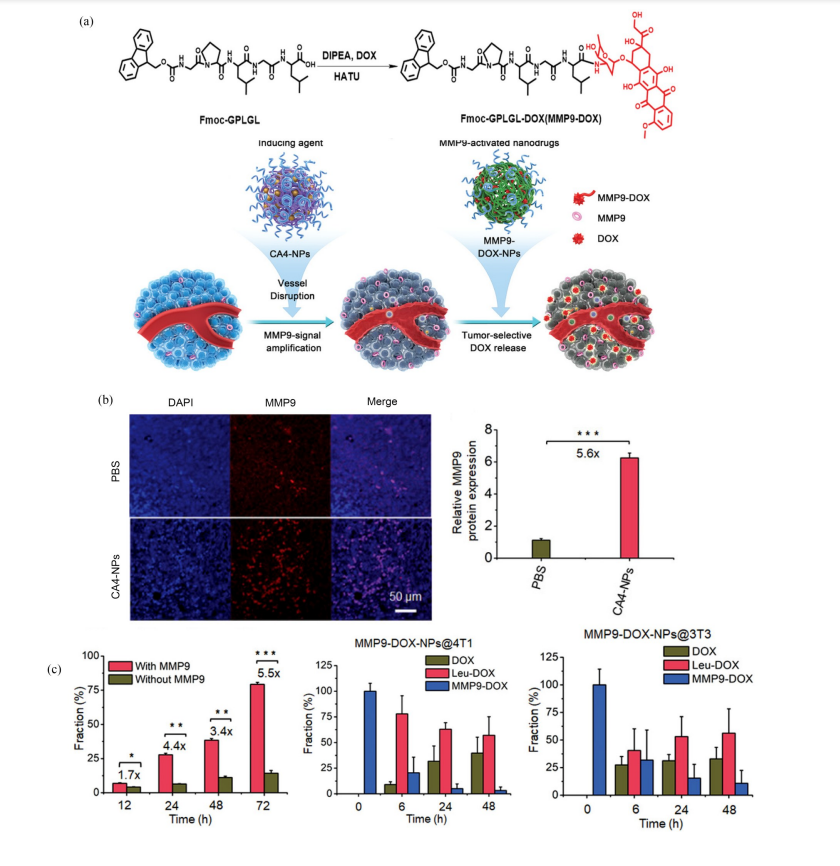
例如:Ding 等[79] 合成了一种聚氨基酸,其 与2,3-二甲基马来酸酐修饰的阿霉素共组装可形 成复合胶束,该胶束能在肿瘤细胞的酸性微环境 中解离并释放阿霉素 . 此外,Chen 等[80]设计了一 种 基 于 多 肽 (Fmoc-Gly-Pro-Leu-Gly-Leu) 的 酶 激活前药,与药物产生级联作用抑制肿瘤生长 (图 5(a)):利用血管阻断剂康普瑞汀(CA-4)选择 性破坏未成熟的肿瘤血管,加剧肿瘤缺氧状态以 诱导癌细胞中MMP-9 过表达(图5(b)) ,进一步协 同MMP-9 激活阿霉素前药(MMP9-DOX-NPs)提高化疗的选择性,减少毒副作用(图5(c)).
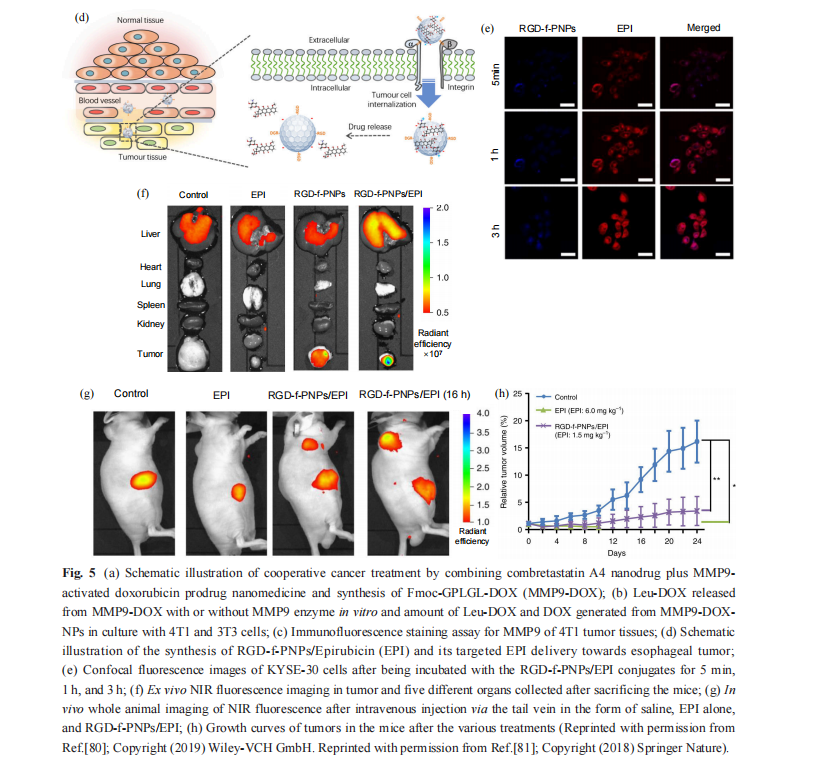
此外,通过赋予多肽/聚氨基酸自组装材料 靶向功能,可有效提高治疗效果并降低化疗药物 的副作用 . Fan 等[81] 设计并合成了一种环八肽 (cyclo(-(D-Ala-L-Glu-D-Ala-L-Trp)2-)) ,其与Zn2+配 位组装形成自荧光环肽纳米粒(f-PNPs). 进一步 修饰具有癌细胞靶向能力的RGD 多肽,使其能 够特异性识别食道癌细胞表面的 αvβ3 整合素,同 时通过 π-π 堆积和电荷吸引作用负载化疗药物表 阿霉素(图5(d)). 随着表阿霉素的逐渐释放,其荧光强度逐渐增强,使得药物在胞内的释放可以在 共聚焦荧光显微镜下实时观测(图5(e)). 此外,动 物实验进一步表明,此自荧光环肽纳米粒作为可 示踪的靶向载药系统可以实现体内肿瘤的特异性 成像(图 5(f))以及药物递送和释放的可视化监测 (图5(g)) ,进而提高了抗癌效率(图5(h)) ,为实时 跟踪病灶区域药物浓度和释放速度提供了新 方法.
纳米药物载体可以通过被动靶向或主动靶向 富集于肿瘤病灶部位[82] ,然而要实现肿瘤深层给药仍需克服多种生理和病理障碍[83~85] . 肿瘤组织 的深层区域由无血管区和各种基质细胞组成,传 统的纳米载体由于肿瘤细胞外基质的致密性和高 间质液压力等障碍,难以实现肿瘤深层药物递 送[86] . 然而,通过外源性物理方式对纳米粒子施 加作用力,可以使其产生形变,从而实现深层肿 瘤组织的主动渗透并诱导/触发纳米药物的释放, 增强肿瘤抑制效果.
为了平衡深层肿瘤渗透和延长血液循环的矛 盾要求,Du 和Fan 课题组[87] 通过自组装制备了 一种“声致变形 ”多肽纳米凝胶 . 首先,将具有 靶向三阴性乳腺癌功能的ICAM- 1 抗体接枝于聚赖氨酸,并与Pluronic F127 共组装,然后通过京 尼平交联形成稳定的纳米凝胶结构(图6(a)). 该纳 米凝胶能够在血液中长期保持稳定,实现长效循 环;在外部超声波的作用下,多肽纳米凝胶能够 实现负载的表阿霉素的响应性释放(图6(b)). 超声 刺激同时也能降低肿瘤组织的间质压力,以促进 深层肿瘤富集 . 同时,多肽凝胶在超声作用后内 空化作用增强而明显膨胀,促进纳米凝胶软化且 变形性增强,利用原子力显微镜获得的力- 曲线 图来检测多肽纳米凝胶在超声刺激前后的硬度变 化,发现凝胶的杨氏模量在超声刺激15min 后从 336.78 kPa 下降到 3.93 kPa (图 6(c)). 此外,超声还可促进F127 分子从多肽纳米凝胶中脱落,进 而导致其形貌变化(图6(d)). 体外模拟三阴性乳腺 癌实体瘤模型表明,该纳米凝胶能在超声作用下 实现更好的肿瘤深层渗透和抑制效果(图6(e)). 小 鼠静脉注射后,相对刚性的纳米凝胶能通过主动 靶向和长效血液循环实现在肿瘤部位高水平的 富集 . 而在超声处理下,肿瘤部位的纳米凝胶变 得更加柔软,通过形变增强实现肿瘤深层穿透 (图 6(f)) ,最终达到低水平的系统毒性和更高水 平的抗耐药性肿瘤效果(图6(g)). 这种兼具内源性 刺激与外源性刺激响应的纳米载体有望解决延长 血液循环和肿瘤深部渗透的矛盾需求.

肿瘤的多药耐药性也是现阶段临床化疗失败 的主要原因之一 . 如何克服肿瘤耐药性,实现耐 药性肿瘤细胞的逆转,对于有效治疗耐药性肿瘤 至关重要 . 最近,Du 和Fan 课题组[34] 以聚赖氨酸 为骨架模块化设计了一种自组装聚氨基酸纳米药 物 . 其在聚氨基酸的侧链上修饰氯尼达明和线粒 体靶向基团三苯基磷,并原位交联了二茂铁和葡 萄糖氧化酶 . 体外实验表明该聚氨基酸纳米药物 具有明显的线粒体靶向性,并诱导了高水平的代 谢抑制 . 此外,葡萄糖氧化酶和二茂铁在细胞内 产生了过量ROS 并进一步诱导了耐药性肿瘤细 胞自噬 . 同时,动物实验也验证了此聚氨基酸纳米药物优异的肿瘤抑制效果.
相较于传统的药物递送系统,体内原位自组 装可以利用生物分子在复杂生理环境下(细胞、 组织和活体) ,通过特异性刺激响应实现其组装 和功能化,达到组装体在病灶部位靶向、富集和 滞留的效果[88] .
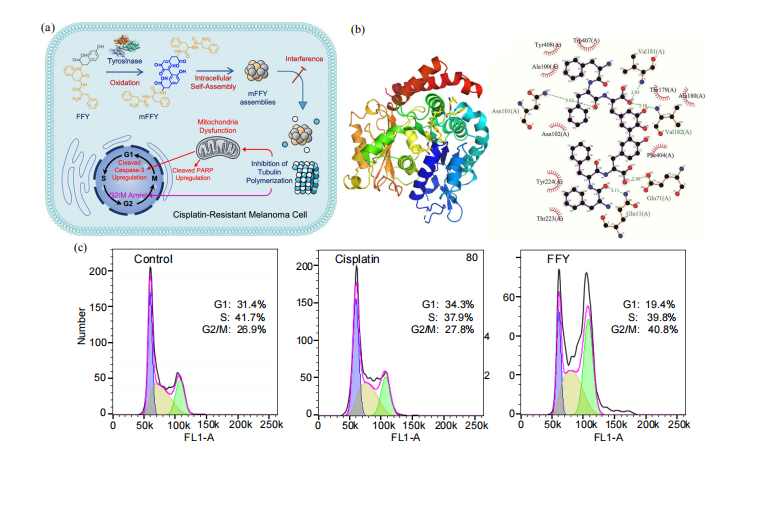
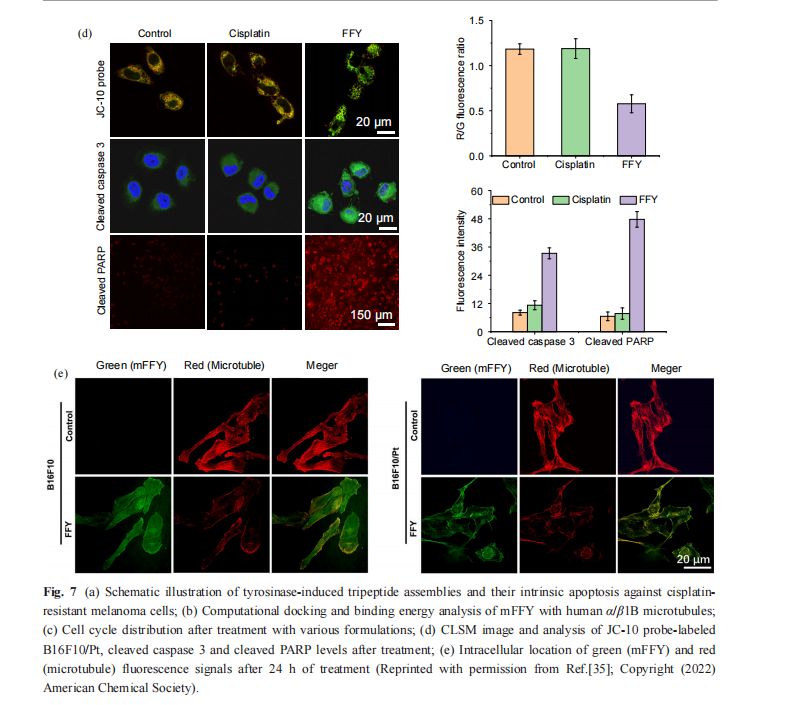
他们还利用多肽的胞内自组装来调控耐药肿 瘤细胞的细胞周期,进而逆转并抑制耐药黑色素 瘤[35] . 首先向耐药黑色素瘤细胞中引入三肽(Phe- Phe-Tyr, FFY) ,在细胞内通过酶促自组装形成了 mFFY 多肽纳米粒(图7(a)). 分子对接模拟发现胞 内氧化后的多肽与人源 “/β1B 微管蛋白形成了更 多的结合位点(图7(b)). 将mFFY 多肽纳米粒与微 管蛋白共孵育后,其能够有效抑制微管蛋白聚 合,导致大多数肿瘤细胞停滞于DNA 合成后期 或分裂间期,从而抑制肿瘤细胞增殖(图7(c)). 同 时,线粒体功能紊乱也诱导了凋亡因子过表达, 如 cleaved caspase 3 (相比对照组提高 3. 1 倍)和 cleaved PARP (提高 6.3 倍) ,这进一步促进了耐 药肿瘤细胞凋亡,最终实现了肿瘤耐药性逆转 (图7(d)). 通过共聚焦荧光成像分析,mFFY 多肽 纳米粒能够有效靶向微管,降低胞内微管蛋白聚 合水平,并利用自发荧光实现胞内微管的特异性 成像(图 7(e)). 动物实验中,在黑色素瘤周注射FFY 后,观察到高水平的耐药肿瘤抑制 . 相对于 化疗药物的治疗,该多肽胞内自组装的方法能够 有效减少系统毒性,有望为耐药肿瘤的治疗提供 新策略.
4 总结与展望
多肽/聚氨基酸分子为生物医用材料的性能 优化、结构调控和功能拓展提供了更大的自由 度,也为临床肿瘤诊疗提供了更多的选择 . 本文 详细介绍了团队近期基于多肽/聚氨基酸自组装 材料在肿瘤诊疗材料领域的研究成果:通过对多 肽自组装结构的调控赋予其可控的光学性质以用 于生物荧光成像,实现了药物递送的可视化监测;构建了基于聚氨基酸的多模态成像材料,其 中聚氨基酸侧链的化学可修饰性增强了药物靶向 性并改善了药代动力学,且通过其良好的生物相 容性和负载能力减少了造影剂的副作用,实现了 骨肿瘤的多模态成像和靶向治疗;通过赋予聚氨 基酸自组装纳米凝胶超声响应性,实现了长效血 液循环并增强了在肿瘤中的主动渗透作用,克服 了肿瘤组织病理微环境对传统纳米载体产生的阻 碍,从而实现了肿瘤内部深层给药,以及针对耐 药三阴性乳腺癌的有效抑制;设计能够在黑色素 瘤细胞中被特异性氧化并组装的小分子三肽,其 能够在胞内组装后阻断微管、抑制细胞增殖并靶 向线粒体促进细胞凋亡,与化疗药物相比,该多肽胞内自组装能够在抑制耐药肿瘤的同时,有效 减少或避免系统毒性.
虽然现阶段多肽/聚氨基酸自组装材料在肿 瘤诊疗领域已取得了重大进展,但鉴于生理环境 的复杂性以及临床需求的多样性,我们对未来诸 多亟待解决的问题进行了展望,例如:
( 1)我们的前期工作实现了多肽在黑色素瘤 细胞内的氧化,能够初步实现细胞周期等细胞生 命活动的调控 . 然而,细胞内微环境的复杂性为 多肽或氨基酸在胞内的可控反应带来了巨大的挑 战 . 通过引入可精确调控的外源物理场,如光、 声、磁等,有望在不影响细胞生理活动的前提 下,对胞吞的氨基酸或多肽分子实现可控的修 饰、聚合等化学反应,进而诱导其自组装为纳米 材料以避免细胞外排 . 同时,该策略还能够大大 延长多肽材料在细胞内的滞留时间,以更好地研 究其在细胞内的生物效应.
(2)现阶段我们已经实现多肽的胞内原位组 装,进而阻断细胞内微管蛋白的聚合以促进肿瘤 细胞凋亡 . 然而,如何赋予多肽/聚氨基酸材料更 丰富的生物活性,进而参与调控更广泛的生命过 程仍然需开展深入研究 . 在未来的研究中,还可以关注如下问题:如何进一步赋予多肽/聚氨基 酸载体更精准的亚细胞器靶向能力,以实现细胞 内分子的高效转运;如何进一步调控多肽与蛋白 质分子或核酸分子的相互作用,进而更精准地调 控细胞周期、细胞分化、细胞信号转导等生命过 程,实现对于相关疾病通路的有效抑制.
(3)多肽分子作为蛋白质的前体分子,具有 与蛋白质相同的基本化学结构,能够实现蛋白质 的部分生物功能 . 蛋白质的生物活性与其复杂的 三级/四级结构密不可分,然而现阶段往往只能 实现多肽/聚氨基酸自组装材料二级结构的调控, 难以可控制备更高级结构的组装体 . 因此,多肽/ 聚氨基酸分子如何实现跨尺度、跨维度的分级自 组装仍是研究难点.
(4)人工智能辅助的多肽/聚氨基酸设计、 自 组装及高级结构预测值得关注 . 人工智能有望使 多肽/聚氨基酸的空间和化学结构匹配目标蛋白 的功能结构域 ,更好地实现类蛋白质的生物 功能.
总之,研究具有精准空间和化学结构和可编 辑生物功能的多肽/聚氨基酸自组装材料,对于新 型生物医药的开发和临床肿瘤诊疗具有重大价值.





