郑鹏课题组结合点击化学和酶催化实现高效稳定的蛋白质固定和单分子测量
蛋白质分子的特异性固定和连接在蛋白的研究和应用中发挥着重要的作用,例如蛋白分子的检测、抗体偶联药物和单分子研究等。传统的固定方法常常依赖于双功能团连接分子,例如带活化酯基团(N-羟基琥珀酰亚胺,NHS)和马来酰亚胺基团(Maleimide, Mal)的交联剂。其中,NHS可与氨基反应,Mal与蛋白中的巯基反应,从而实现将蛋白质的特异性固定于带有氨基的物质上。但是NHS易水解失效不易保存,影响反应的成功率,而Mal可以与蛋白质中所有暴露的巯基反应,影响反应的特异性。
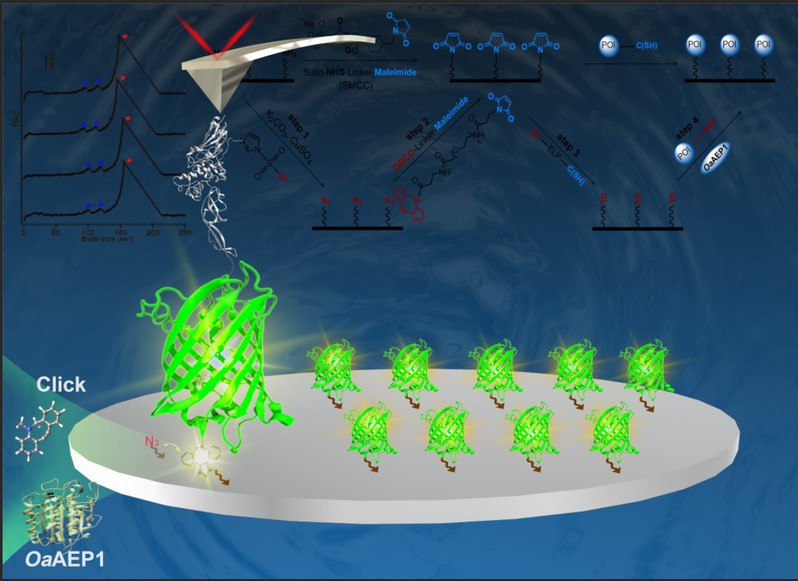
为解决这些问题,寻找一种高效稳定的蛋白固定方法,南京大学化学化工学院郑鹏教授课题组最近开发了一种结合了应变促进叠氮化物-炔烃环加成(SPAAC)点击化学反应和基于OaAEP1 的酶催化连接反应的方法(图1)。
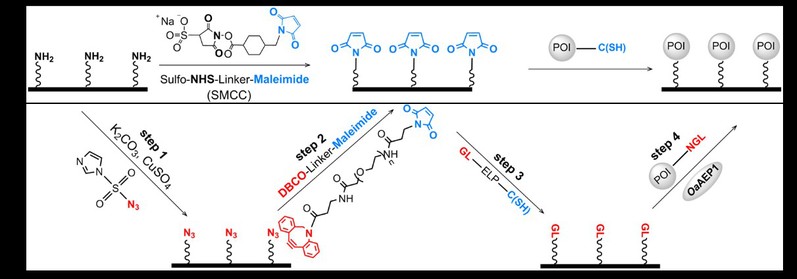
图1. 结合了SPAAC点击化学反应和酶催化连接反应的方法示意图
通过该方法,荧光成像结果显示eGFP被成功的固定于玻璃片表面(图2)。单分子力谱结果显示肌肉蛋白(I27)8可以固定于玻璃表面且正确折叠(图3)。在实验中,该方法的成功率可达~90%,实现了稳定的样品制备。将该方法用于测定SPAAC反应产物的力学稳定性,得到其断裂力大于1.7 nN(图4)。所以,这种方法不仅实现了蛋白质的高效稳定特异性修饰,也可以广泛应用于蛋白质的测量,特别是单分子力谱的研究中。
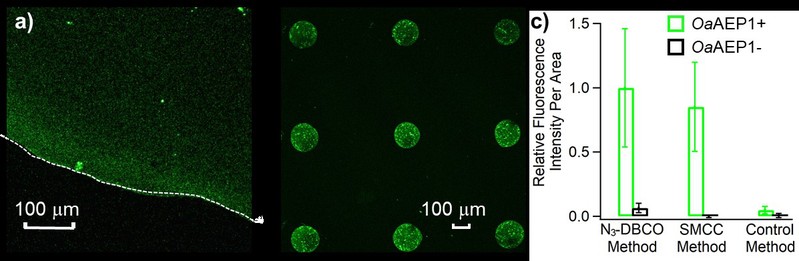
图2. 荧光成像表征eGFP被固定于玻璃片表面
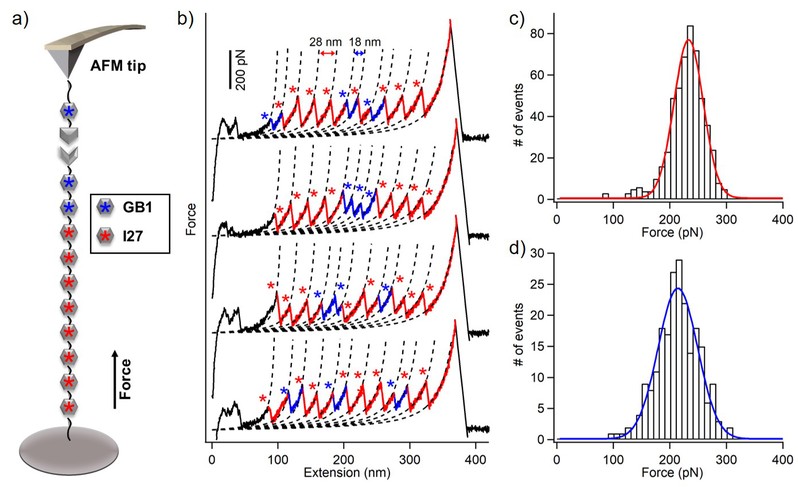
图3. 单分子力谱结果显示 (I27)8 的解折叠情况
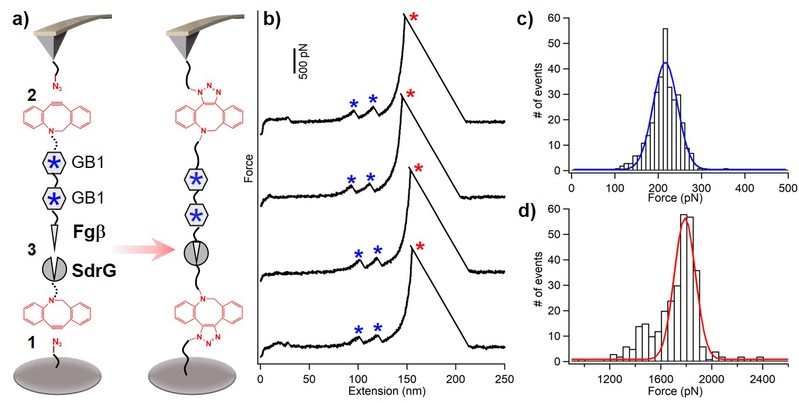
图4. 单分子力谱结果测定SPAAC点击化学反应产物的断裂力大于1.7 nN
相关研究成果以“combination of SPAAC click chemistry and enzymatic ligation for stable and efficient protein immobilization for single-molecule force spectroscopy”为题发表在CCS Chemistry期刊上(DOI: 10.31635/ccschem.021.202100779)。南京大学2017级博士生时胜超为本文第一作者,郑鹏教授为通讯作者。该项目在郭子建院士的启发和指导下开展,南京大学李劼教授、刘颖教授、叶德举教授和庞洁老师对项目给予了大力帮助。研究工作得到了南京大学配位化学国家重点实验室、化学与生物医药创新研究院,国家自然科学基金、江苏省自然科学基金等支持或资助。
版权与免责声明:本网页的内容由收集互联网上公开发布的信息整理获得。目的在于传递信息及分享,并不意味着赞同其观点或证实其真实性,也不构成其他建议。仅提供交流平台,不为其版权负责。如涉及侵权,请联系我们及时修改或删除。邮箱:sales@allpeptide.com